
心窩部の痛みやもたれ、飽満感などを有する病態です。これらの上腹部症状は消化性潰瘍などの器質的な病態によっても発現しますが、上部消化管内視鏡検査などをしても器質的な異常が見つからない場合も多々あります。これら、器質的な病変が同定できない、つまりは機能的な異常が原因となるのが機能性ディスペプシアです。機能的な異常であり、食品による改善も十分に期待できます。
機能性ディスペプシアは、過敏性腸症候群(IBS)とともに機能性消化管障害(functional gastrointestinal disorders: FGIDs)に属します。機能性消化管障害とは、消化管粘膜などに器質的な異常を認めず、消化管運動の異常など機能的な異常が原因の疾患をまとめたもので、IBS と機能性ディスペプシアが機能性消化管障害を代表する2大疾患です。IBSが主に大腸の機能的な異常により発症するのに対し、機能性ディスペプシアは主に「胃」の機能的な異常により発症します。
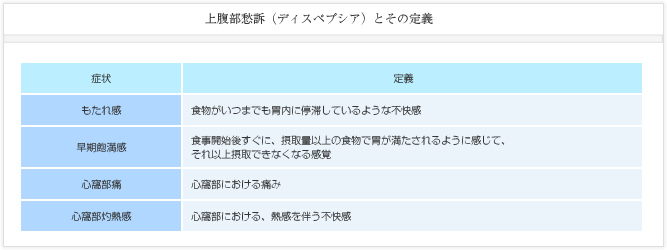
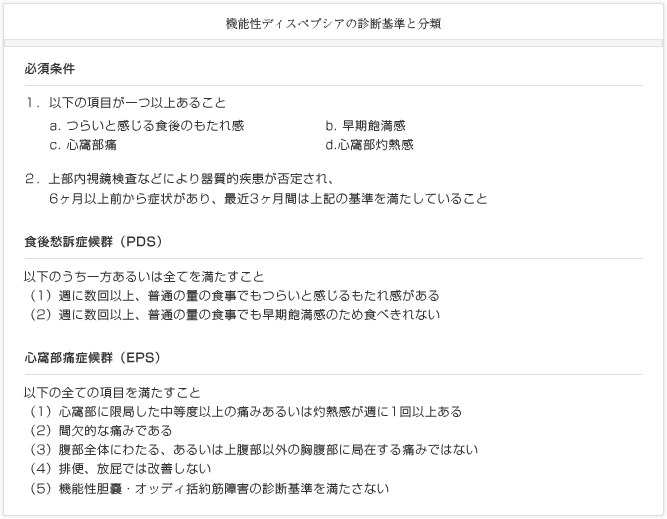
機能性ディスペプシアもIBSと同様にRomeIII診断基準に基づいて診断されます。その中でディスペプシア(上腹部愁訴)は、(1)心窩部痛、(2)心窩部灼熱感、(3)もたれ感、そして(4)早期飽満感の4つとして定義されます。これら4つのディスペプシア症状のうち1つ以上を慢性的に有しており、かつ上部消化管内視鏡検査などにより癌や消化性潰瘍などの器質的な異常が確認されない場合、機能性ディスペプシアと診断されます。
さらに詳細には、機能性ディスペプシアは、食後愁訴症候群(postprandial distress syndrome: PDS)と心窩部痛症候群(epigastric pain syndrome: EPS)の2つに分類されます。食後愁訴症候群は食後のもたれ感や摂取開始後すぐに満腹感を覚える早期飽満感を主症状にするものであり、一方、心窩部痛症候群は、排便などでは改善しない心窩部の痛みや灼熱感を主症状にします。
機能性ディスペプシアの病態は単純ではなく複数の因子が関与します。その中で特に、1.消化管の運動機能異常、2.内臓知覚過敏、そして3.心理的因子が重要です。
消化管運動異常は機能性ディスペプシアの発症要因として古くから知られており、その病態的関与についてはほぼ確立しています。この消化管運動異常として代表的なものに、(1)胃排出遅延、(2)適応性弛緩反応障害、(3)胃電気活動異常などが挙げられます。
胃に入った食物は胃の前庭部(十二指腸に近い部分)の収縮力により十二指腸に排出されます。機能性ディスペプシアでは、この胃排出能が低下しており、胃排出の遅延がみられます。機能性ディスペプシア患者の20~40%にこの胃排出遅延がみられます。
胃排出能は胃内の食物を排出する能力ですので、食後の胃の運動機能の一つです。胃排出遅延により食物が胃に長く停滞することで、胃もたれ、食後膨満感、嘔気などの症状の発現につながります。よって特に、食後愁訴症候群(PDS)との関連が推察されます。
この胃排出能の測定法にはいくつかありますが、直接法では、X線不透過マーカーを用いたX線法や、アイソトープでラベルした試験食を摂取し経時的に放射能活性を測定するアイソトープ法などがあります。間接法には、安定同位体元素である13C化合物を混入した試験食を摂取してもらい、経時的に呼気中の13Cを測定する13C呼気試験法がよく用いられます。この13C呼気試験法は被爆などの問題もなく、機能性食品の評価にも活用できます。
適応性弛緩反応とは、摂食により一定量以上の食物が胃内に入った折に近位胃(食道に近い部分)が拡張する反応のことです。これは食事摂取後に胃が拡張することで容量を増やし、より多くの食物の受け入れを可能にしようとする弛緩反応で、胃の貯留機能を反映します。
機能性ディスペプシア患者の約40~50%がこの適応性弛緩反応障害を示します。この適応性弛緩反応が障害されると、胃の拡張がうまく行われませんので、多くの食物を受け入れることができなくなり、早期飽満感の形成につながります。さらに、胃の内圧の上昇を来たしますので、上腹部痛や不快感の形成にも関連します。
この適応性弛緩反応の測定法としては、IBSの評価にも使用されるバロスタット法が用いられます。IBSにおいては大腸にバルーンを留置しますが、機能性ディスペプシアにおいてはもちろん胃内(正確には胃底部)にバルーンを留置します。そして、試験食摂取後の容量や内圧の変化を記録します。ただこの測定法は苦痛を伴いかつ特殊な装置を必要とすることから、近年ではこのバロスタット法に代わり、より簡便なドリンクテストが行われています。これは非常に単純で、栄養剤あるいは水をどれだけ飲むことができるかを評価します。間接的な評価法ではありますが、弛緩反応の簡便な評価法と考えられています。
胃の活動電位は、基本リズムであるslow waveと収縮に結びつくplateau potentialから構成されます。この胃の活動電位を体表面から測定する方法として、経皮的胃電図(electrogastrography: EGG)があります。
このEGGを用いた検討により、機能性ディスペプシアでは、% of normogastria(2~4 cpmの正常周波数波形が全波形中に占める割合)の低下、異常周波数波形であるtachygastriaやbradygastria成分の増加、胃の収縮力を反映するパワー比(食後パワー/食前パワー)の減少などがみられます。
胃を含めた消化管には、迷走神経が分布しています。そして、消化管の運動や知覚、分泌などに対する重要な役割を担っています。内臓知覚過敏とは、文字通り消化管の知覚が過敏になっている状態を表しますが、詳細には、知覚閾値が低下しているallodynia(異痛症)と、健常者も自覚する程度の刺激に対してより強く知覚を自覚するhyperalgesia(痛覚過敏)に分けられます。胃における刺激系としては、胃の運動や内圧の上昇などによる物理的刺激と胃酸や食物などによる化学的刺激が存在します。
前述にように機能性ディスペプシアでは、胃の排出能の低下により胃内に食物が長時間停滞します。このことにより持続的に胃壁が伸展され、また食物による化学的刺激に長時間暴露されます。さらには、適応性弛緩反応障害も存在することから、胃の内圧の上昇からやはり胃壁の過剰な伸展がもたらされます。これらにより知覚過敏性が惹起され、低刺激での腹部膨満感や早期飽満感、腹部不快感、痛みなどにつながることが示唆されています。またバロスタット法による検討においても、バルーンによる伸展刺激による痛覚閾値の低下を示すことが知られています。
胃酸の関与については興味深い知見が集積しています。胃酸の基礎分泌あるいは最大刺激分泌は機能性ディスペプシア患者と健常人では差がなく、過剰な胃酸分泌はディスペプシア症状の発現には直接的には関与しません。ところが十二指腸への胃酸の暴露が胃の運動を抑制することが知られており、“十二指腸ブレーキ”と呼ばれています。さらには、適応性弛緩反応障害をも惹起することが報告されています。これらは上述と同様の機序により知覚過敏をもたらします。つまり、過剰ではなく生理的範囲内の胃酸分泌が間接的に内臓知覚過敏を介した症状の発現に寄与しています。事実、プロトンポンプインヒビター(PPI)をはじめとした胃酸分泌抑制薬が機能性ディスペプシアに対して有効であるとする報告は多く、アメリカ消化器病会議のガイドラインにおいてはPPIが第一選択薬となっています。
食事性因子による刺激については、脂質やデキストロースを十二指腸内に暴露すると嘔気が軽度上昇したり、飽満感や腹部不快感が増強することが示されています。欧米型の食生活への変貌と近年の機能性ディスペプシア有病率の増加には関連があるかもしれません。
医療機関を受診した機能性ディスペプシア患者においては、パニック症候群と同程度の社会的ストレスを受けていたこと、そして心理的状態としてはうつ的要素あるいは不安的要素が強いことが報告されています。そして、ストレス負荷を伴うカテコラミンなどは消化管の運動を抑制すること、さらには被験者に不安を与えると胃の容量が低下し腹部不快感を生じるという報告があります。心理的要因は、適応性弛緩反応障害や内臓知覚過敏を介して自覚症状の形成に寄与しているものと考えられます。

監修:大阪大学名誉教授 川野淳先生
文責:総医研クリニック 西谷真人






